FDA PHÊ DUYỆT SABRIL TRONG ĐIỀU TRỊ ĐỘNG KINH Ở TRẺ NHỎ.
Ngày đăng: 02/09/2009

Lượt xem: 12453
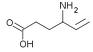
Dung dịch uống Sabril (vigabatrin) được FDA phê duyệt trong điều trị động kinh ở trẻ nhỏ từ 1 tháng đến 2 tuổi. Sabril là thuốc đầu tiên được Hoa Kỳ phê duyệt trong điều trị các rối loạn thường xảy ra vào năm tuổi đầu tiên (thường xảy ra vào tháng thứ 4 đến tháng thứ 8).
Sabril (vigabatrin) – dạng viên uống đã được phê duyệt trong điều trị các dạng động kinh cơn cục bộ phức tạp không đáp ứng với các trị liệu trước đó ở người lớn (kết hợp với các thuốc khác).
Theo Rurssell Katz, M.D., Trưởng nhóm các sản phẩm về thần kinh ở Trung tâm nghiên cứu và đánh giá các sản phẩm thuốc FDA nói: “Động kinh làm suy giảm chức năng thần kinh và giảm chất lượng cuộc sống. Động kinh ở trẻ nhỏ rất nghiêm trọng và việc phê duyệt sản phẩm này cung cấp thêm một sự lựa chọn điều trị”.
Sử dụng Sabril có thể gây ảnh hưởng đến thị giác. Sự mất dần thị giác ngoại vi dẫn suy đến suy giảm thị lực. Nguy cơ này gia tăng theo liều dùng và thời gian dùng thuốc, nhưng ngay cả sử dụng Sabril ở liều thấp nhất cũng có thể ảnh hưởng đến thị giác. Vì vậy việc kiểm tra thị lực trong quá trình dùng thuốc là bắt buột. Vì nguy cơ mất thị lực không hồi phục nên việc dùng thuốc này chỉ giới hạn trong một số trường hợp.
Sabril là một loại thuốc hiếm trong điều trị động kinh ở trẻ nhỏ. Ở Hoa Kỳ, các thuốc được xếp vào nhóm hiếm khi được nghiên cứu để điều trị bệnh cho ít hơn 200.000 người. Các chính sách về thuốc hiếm tạo động lực cho các công ty nghiên cứu và phát triển thuốc điều trị các hội chứng hoặc các bệnh hiếm gặp. Sabril được sản xuất bởi Lundbeck Inc. of,
Đăng bởi: DS. ĐOÀN VÂN TUYỀN Nguồn FDA NEWS RELEASE, Aug. 21, 2009.
Các tin khác

THÔNG TIN THUỐC THÁNG 5 / 2013 21/08/2013

THÔNG TIN THUỐC THÁNG 6 / 2013 21/08/2013












(1).png)

.jpg)

.jpg)


.jpg)

.png)
.png)

.png)
.png)


